Растения
антигонадотропного действия также не были лишены внимания исследователей.
Хотя нужно отметить, что делалось это скорее из соображений разработки
новых противозачаточных средств, нежели применительно к схеме лечения
онкологического больного. Научному изучению подвергались растения, в
отношении которых имелась информация, почерпнутая из опыта народной
медицины, как о средствах, препятствующих возникновению беременности.
Исследования in vitro и in vivo на лабораторных животных указали на
гипоталамо-гипофизарную систему как на очевидную точку приложения эффектов
извлечений из растений данной группы. Блокируя выработку гипофизом фолликулостимулирующего
и лютеинизирующего гормонов, антигонадотропные растения вызывали опосредованное
снижение секреции эстрадиола яичниками и тестостерона яичками, и как
следствие нарушение репродуктивной функции животных.
В настоящее
время в онкологии активно применяются антигонадотропные медикаменты,
подавляющее большинство из которых по своей сути являются агонистами
гонадотропного релизинг-гормона гипоталамуса [4,
5]. Сфера их применения ограничена опухолями
гормонозависимой сферы (рак молочной и предстательной желез, яичников,
эндометрия и яичек), которые, тем не менее, имеют огромный удельный
вес среди всех онкологических заболеваний. Достаточно сказать, что опухоли
молочной железы, составляющие 20% всех случаев онкологических больных,
непререкаемо лидируют как по частоте возникновения, так и по причине
смертности среди онкозаболеваний у женщин. Антигонадотропные медикаменты
реализуют терапевтический подход – устранение гормональной стимуляции
опухоли, – путем снижения функции половых желез, что происходит опосредованно
благодаря выключению центрального стимулирующего механизма.
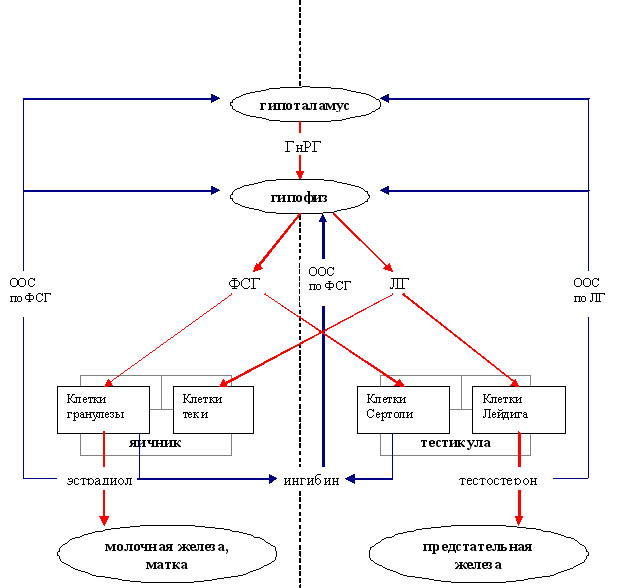
Регуляторная ось гипоталамус – гипофиз – гонады.
Регуляторная
ось гипоталамус – гипофиз – гонады является сложной иерархической структурой
эндокринной системы, призванной поддерживать гормональный гомеостаз в сфере
половых гормонов.
Гипоталамус в импульсном режиме с частотой
1 раз в 90 минут секретирует гонадотропный релизинг-гормон (ГнРГ). Посредством
его гипоталамус управляет гипофизом в части, касающейся выработки половых
тропинов – ФСГ и ЛГ. Нужно отметить, что полярность воздействия ГнРГ зависит
от того, в каком режиме он секретируется. В норме секреция носит импульсный
характер с заданной амплитудой и частотой, данный сигнал воспринимается гипофизом
как стимуляция. При изменениях частоты и амплитуды секреции ГнРГ как в большую,
так и в меньшую сторону, может происходить снижение гонадотропной активности
гипофиза.
Под влиянием ГнРГ гипофиз секретирует
в кровь фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны, от концентрации
которых напрямую зависит гормональная продукция в яичниках и яичках, а также
деление и созревание половых клеток (яйцеклетки и сперматозоида соответственно).
Выработка эстрадиола фолликулярными клетками в яичниках находится под контролем
ФСГ, а тестостерона яичками (клетки Лейдига) – ЛГ. (см.
схему)
Существует обратная связь между центральными
отделами регуляции и «периферией». По мере нарастания концентрации половых
гормонов в крови меняется ритм секреции ГнРГ и чувствительность гипофиза к
нему, в результате чего продукция гипофизарных тропинов меняется. Концентрация
гонадотропина, ответственного за секрецию половых стероидов, понижается. Уровень
тропина, контролирующего деление гамет, возрастает.
Отрицательная обратная связь реализуется
также за счет ингибина, вырабатываемого половыми железами. Его концентрация
нарастает параллельно концентрациям половых стероидов [6].
Антигонадотропные средства
и место в онкологической практике.
Первоначально
антигонадотропный эффект был получен в результате применения больших доз половых
стероидов, воздействующих на рецепторы гипофиза по механизму отрицательной
обратной связи. Данный подход по понятной причине далеко не всегда может быть
использован в случае гормонозависимой опухоли. С этой целью применяются синтетические
препараты типа далацина (синтетический андроген), имеющие существенные ограничения
у женщин и полностью противопоказанный при раке предстательной железы у мужчин.
В последнем случае применяются антиандрогенные препараты (например, андрокур),
также обладающие некоторой антигонадотропной активностью.
В настоящее время наиболее актуальны
антигонадотропные препараты, представляющие собой вещества, по химическому
строению близкие ГнРГ. Замена всего одной аминокислоты в структуре человеческого
ГнРГ приводит к изменению свойств данного гормона. В данном случае имеются
два принципиально различающихся пути. Одни вещества, образующиеся в результате
замены аминокислоты в составе ГнРГ, обладают свойствами стимулировать гипофиз,
в десятки раз превосходящими сам ГнРГ (агонисты ГнРГ). Другие же напротив,
не обладают стимулирующими свойствами, но, конкурентно связываясь с рецептором
ГнРГ на гонадотрофах гипофиза, надежно закрывают их от последнего.
Агонисты ГнРГ – бусерелин, гозерелин,
нафарелин, декапептил, лейпролид – после введения в организм вызывают кратковременное
усиление гонадотропной функции гипофиза с последующим длительным и стойким
угнетением. Разработка лекарственных форм, позволяющих редкие введения (депо-формы,
например, Золадекс), сделали эти препараты на настоящее время «золотым стандартом»
антигонадотропной терапии гормонозависимых форм рака [4,
5].
Антигонадотропные препараты применяются
в комплексной терапии рака молочной железы у менструирующих женщин с рецепторно-положительными
вариантами опухоли, и у мужчин, страдающих раком предстательной железы, не
подвергавшихся орхиэктомии. В меньшей степени агонисты ГнРГ находят место
в лечении опухолей яичников и яичек, рака эндометрия и эндометриоза как предопухолевого
состояния.
В соответствующих исследованиях было
показано, что медикаментозная кастрация, вызываемая золадексом, не уступает
по эффективности хирургическому удалению гонад, при этом эффективность оценивается
в 80%. В связи с этим до 70% больных раком предстательной железы предпочли
именно этот метод лечения. При этом, как было показано в метаанализе 10 исследований,
включавших 1908 больных раком предстательной железы, не было обнаружено разницы
в выживаемости больных после хирургической и медикаментозной кастрации. При
диссеминированном раке предстательной железы после введения золадекса PSA
уменьшается у 90% пациентов, а боли – у 68%. Объективный эффект достигается
у 75-85% больных, средняя выживаемость составляет 24-30 месяцев, а время до
прогрессирования 12-18 месяцев.
При диссеминированном раке молочной
железы у менструирующих женщин золадекс дает эффект у 30% больных при 1-ой
линии гормонотерапии и 20% - при 2-й, со средней выживаемостью 2,5 года [5].
Было также показано, что сочетания агонистов ГнРГ и антиандрогенных и антиэстрогенных
средств дают более выраженное лечебное действие.
Еще одно показание для назначения антигонадотропных
препаратов в онкологии продиктовано соображениями профилактики репродуктивных
нарушений в период химиотерапии. Как известно, химиопрепараты оказывают повреждающее
действие на любые недифференцированные клетки в организме. Особенно подвержены
такому воздействию клетки, находящиеся в процессе деления. Половые клетки
(яйцеклетки и сперматозоиды) у больных репродуктивного возраста пребывают
на различных этапах деления практически постоянно, в результате чего попадают
под удар в ходе химиотерапии. Контроль над интенсивностью деления гамет имеют
половые тропины гипофиза и половые стероиды. В ходе экспериментальных работ
и клинических наблюдений было установлено, что подавление гонадотропной активности
гипофиза посредством агонистов ГнРГ, приводит к значительному замедлению делению
половых клеток и, как следствие, меньшей их подверженности химическому поражению.
Таким образом, средства, способные
блокировать выработку половых тропинов гипофиза, являются в настоящее время
неотъемлемой частью медикаментозной терапии определенных категорий онкологических
больных.
Антигонадотропные растения.
Экспериментальные данные.
Антигонадотропные
растения как обособленная группа определились совсем недавно, хотя знания
об их применении исчисляются не одной тысячей лет. Ранее, пока не сформировалось
понимание роли и механизмов работы гипофиза и не определились точки практического
приложения этих знаний, антигонадотропные растения являлись частью весьма
обширной и разнородной группы противозачаточных средств. Нет ничего странного
в том, что именно такое утилитарное применение антигонадотропов в первую очередь
обратило на себя внимание. Яркое фармакологическое действие с четкой причинно-следственной
связью «дал лекарство – получил эффект» приковывало внимание лекаря прошлых
веков, лишенного каких бы то ни было методов объективизации состояния биологического
объекта, кроме собственных глаз, пальцев и ушей. Растения, обладавшие самым
выраженным антигонадотропным эффектом, даже получали ботаническое видовое
название, кратко и емко описывающее его действие. Так, воробейник получил
название Lithospermum от лат. lithos – камень, и sperma – семя. Выдающийся
средневековый армянский врач Амирдовлат Амосиаци переводит с латыни это название
как «высушивающий семя» [3].
Впрочем, число старых противоопухолевых
травяных прописей с участием антигонадотропных растений так же весьма значительно.
Однако в них интересующие нас травы попадали, по всей вероятности, не только
из-за своих антигонадотропных свойств, но и из-за наличия у них прямого противоопухолевого
и иного эффекта, необходимого для лечения онкологического больного. В качестве
примера можно привести окопник лекарственный, широко применявшийся в лечении
рака легких, молочной железы и прямой кишки, а также костных метастазов разных
опухолей.
Качественный скачок в знаниях о травах,
позволивший объединить несколько растений в группу антигонадотропов, произошел
чуть более полувека назад, когда независимые группы ученых в разных странах
проводили скрининг новых противозачаточных и антигормональных средств (Noble
и соавт. (1954), Kemper F., Loeser A., Mikulicz (1955, 1956,
1959, 1961), Wagner H. и соавт. (1970), Гаммерман
А. Ф. и соавт. (1975), Farnsworth N.R. и соавт.
(1975), Манько И. В. и соавт. (1977)). При этом изучались
старые рецепты и травяные прописи, из которых выбирались наиболее часто повторяющиеся
растения. Для объяснения механизма их действия использовались существующие
фундаментальные знания о функционировании репродуктивной системы. В конце
концов, оказалось, что ряд растений обладает способностью подавлять выработку
половых тропинов гипофизом в ответ на стимуляцию ГнРГ. Данный эффект опосредован
полифенолами, производными кофейной кислоты, и в первую очередь литоспермовой
кислотой. Впервые в чистом виде литоспермовую кислоту выделили из воробейника
рудерального — Lithospermum ruderale Gurke (Johnson G. с
соавт., 1963).
Kemper F. и Loeser A. в период с 1955 до 1961 года изучали
антигонадотропные эффекты воробейника лекарственного и зюзника виргинского.
Они вводили самкам крыс и морским свинкам сухозамороженный экстракт из указанных
растений, разведенный в физрастворе, в комбинации с различными естественными
гонадотропинами (10 IU постменопаузального гонадотропина (ПМГ), 2 IU хорионического
гонадотропина (ХГ) или 5 мг сухозамороженного экстракта передней доли гипофиза).
Растительные экстракты смешивали с одним из гонадотропинов и после инкубационного
периода в 2 часа при температуре 37 ° C инъецировались животным: ПМГ инъецировалась
однократно, экстракт передней доли гипофиза дважды (первый и третий день),
и ХГ пять раз (с первого по пятый день). Животные из группы контроля получали
аналогичный объем физраствора в выше указанные сроки. Другие группы животных
получали только соответствующие гормоны на физрастворе без добавления экстракта
растений. Через 120 часов после первой инъекции, крысы подвергались эвтаназии,
забирались яичники и матка, взвешивались и подвергались гистологии.
В группах, получавших чистые гонадотропины
наблюдалось закономерное увеличение массы матки и яичников. Введение гонадотропинов
в сочетании с экстрактами воробейника и зюзника характеризовалось отменой
эффекта гонадотропинов. При этом наблюдалась зависимость от дозы растений.
Мало того, по мере дальнейшего повышения доз растительных экстрактов масса
указанных органов снижалась ниже нормальных значений, из чего авторы сделали
вывод о блокировании гонадотропного эффекта не только вводимых гонадотропинов,
но и собственных гонадотропинов экспериментальных животных. Эффект воробейника
и зюзника был примерно одинаковым. На тот момент времени еще не существовало
понятия о том, какие именно вещества в составе растений обладают антигонадотропным
эффектом [16].
В работах Wagner H. и
соавт. (1970) [21] была показана связь антигонадотропного
действия с присутствием в растениях полифенольных кислот. Было доказано, что
окисленные полимеры литоспермовой кислоты имеют наибольшую антигонадотропную
активность, характерную для растений семейства Бурачниковых, в том числе окопника
лекарственного, а также зюзника европейского из семейства Губоцветных. На
крысах была исследована способность литоспермовой кислоты блокировать эффект
10 МО фолликулостимулирующего гормона. Установлено, что очищенная литоспермовая
кислота самостоятельно антигонадотропных свойств не проявляет. Такой эффект
появляется после инкубации в течение 1 часа литоспермовой кислоты с ферментными
препаратами фенилоксидазы, выделенными из листа зюзника лекарственного и листа
окопника лекарственного (специфический окислитель фермент катехолоксидаза
выделен из зюзника и черного тополя Rompel A. c соавт. в
1999 году[18, 19]).
Антигонадотропная активность увеличивается
после добавления к инкубационной смеси рутина или хлорогеновой кислоты. Очевидно,
антигонадотропная активность лежит в основе выраженного контрацептивного эффекта
(до- и постимплантационного) окисленного полимера литоспермовой кислоты, который
наблюдали И. В. Манько и соавт. (1977). Противозачаточное действие препарата
отмечено у 82,6% спаренных крыс, которое проявлялось и при подкожном, и при
пероральном введении. При этом общее состояние и сексуальное поведение животных
не изменялись. На фоне лечения препаратом наблюдалось снижение массы яичников
животных и содержания аскорбиновой кислоты в тканях, что указывает на влияние
литоспермовой кислоты посредством гипоталамо-гипофизарных механизмов регуляции.
Далее Chatterton RT.
(1981), изучая антигормональные средства, показал, что литоспермовая кислота
является потенциальным средством для контрацепции с эффектом, нарушающим гонадотропную
поддержку овуляции [10].
Позднее Findley W.E.
и соавт. (1985) исследовали эффекты очищенной литоспермовой кислоты и ее оксидов,
выделенных из воробейника рудерального, на высвобождение ЛГ in vitro. Культуру
клеток гипофиза обработали указанными веществами и потом подействовали ГнРГ.
В присутствии ГнРГ оксиды литоспермовой кислоты оказались в 10 раз более мощными,
чем сама кислота, в подавлении высвобождения ЛГ. В отсутствии ГнРГ оксиды,
но не сама литоспермовая кислота, приводили к повышению высвобождения ЛГ.
После отмывания культуры от тестируемых веществ, на клетки подействовали ГнРГ.
Подавление высвобождения ЛГ наблюдалось в тех культурах, на которые подействовали
оксидами, но не самой литоспермовой кислотой. Результаты говорят о том, что
антигонадотропной активностью обладают именно оксиды литоспермовой кислоты,
входящие в состав воробейника рудерального. Авторы предположили, что механизм
действия веществ, скорее всего, опосредован через мембраны гонадотропов гипофиза
[13].
Auf'mkolk M. с соавт. (1984) сообщают о блокаде присоединения
хорионического гонадотропина к мембранам клеток яичек в условиях применения
сухозамороженного экстракта воробейника лекарственного и зюзника европейского
[9]. Эти же авторы, используя метод ВЭЖХ показали,
что из 34 веществ, выделенных из растений в чистом виде, только 4 подавляют
эффект гипофизарных тропинов. Этими веществами оказались окисленные полифенольные
кислоты – розмариновая, эллаговая, хлорогеновая и кофейная – близкие родственники
литоспермовой кислоты, а также лютеолин-7-бета-гликозид [8].
Для растений семейства Бурачниковых
наличие в составе литоспермовой кислоты является таксономическим признаком.
Выделенная впервые из воробейника, литоспермовая кислота была обнаружена во
многих представителях семейства – окопнике лекарственном, синяке обыкновенном,
чернокорне лекарственном, анхузе лекарственной.
Помимо Бурачниковых довольно высокое
содержание литоспермовой кислоты установлено в уже упомянутом зюзнике, в черноголовке
лекарственной, лапчатке белой, а также в шалфее многокорневищном. Последний
является одним из часто используемых средств традиционной китайской медицины,
известным под названием Дан-шен. Благодаря его популярности китайскими, корейскими
и японскими учеными к настоящему моменту уже проведено и проводится большое
количество разноплановых экспериментов, по результатам которых сообщается
об антигипоксантной, противоишемической, противовирусной, гепатопротекторной,
ангиопротекторной, антифибротической активности литоспермовой кислоты и близких
к ней полифенолов, входящих в состав шалфея многокорневищного [7,
11, 14, 15,
17, 20].
Практическое применение.
Мы в
своей практике активно используем антигонадотропные растения в комплексе лечебных
мероприятий у онкологических больных по следующим показаниям:
1. Рак предстательной железы у пациентов,
не подвергавшихся орхиэктомии
2. Рак молочной железы у женщин с сохраненной менструальной функцией
3. Рак эндометрия у женщин с сохраненной менструальной функцией
4. Рак яичка
5. Рак яичников
6. При раке любой локализации у пациентов обоих полов для сохранения репродуктивной
функции на фоне ПХТ.
7. Гормонозависимые предопухолевые состояния – эндометриоз, некоторые формы
мастопатии, отдельные случаи доброкачественной гиперплазии предстательной
железы.
В связи
с тем, что фитотерапия является методом лечения, ориентированным на многоплановое
воздействие на организм больного, антигонадотропные растения применяются в
составе целостной схемы траволечения. Дополняя собой противоопухолевые растения,
антиметастатики, антиоксиданты и антигипоксанты, гепатопротекторы, нефропротекторы,
сердечные и прочие другие средства, растения из группы антигонадотропов нередко
в себе сочетают если и не все, то многие из перечисленных свойств. Так, например,
шиконин, входящий в состав многих Бурачниковых, демонстрирует противоопухолевую
активность по отношению к различным культурам злокачественных клеток, связанную
с усилением их апоптоза.
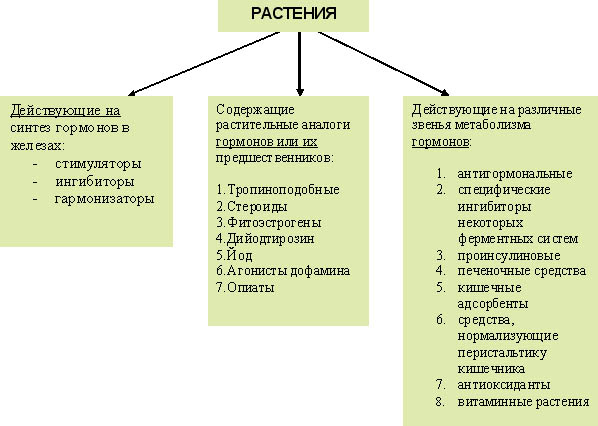
Ранее мы уже предлагали выделять в
составе целостного курса траволечения группу растений, ориентированных в своем
воздействии в основном на гормональную сферу. Нами было предложено называть
данную группу растений гормонорегулятоным блоком (ГРБ) [1,
2]. В ГРБ могут входить травы, действующие на самые разные стороны гормональной
регуляции. Ориентировочную классификацию гормонорегуляторных растений
мы также предлагали ранее [1] (см.
приложение 2).
ГРБ в схеме лечения больных раком молочной или предстательной железы
может включать в себя:
1. антигонадотропное растение, даваемое для
усиления свойств в сочетании с зюзником, окопником или тополем и рутинсодержащим
растением (например, софорой японской);
2. антигормональное растение, блокирующее эффект половых стероидов (например,
растения богатые изотиоцианатами и глюкозоинолатами, - представители семейства
Капустных – ярутка полевая);
3. растения – селективные эстроген (андроген)- рецепторные модуляторы, содержащие
флавоноиды генистеин, дайдзеин, нарингенин, формононетин, апигенин.
4. растения, понижающие уровень глюкозы в крови. Только по показаниям, в
основном у больных, страдающих диабетом, или у тучных больных, склонных
к гиперинсулинемии.
5. гепатопротекторы и кишечные адсорбенты для улучшения метаболизма и выведения
половых стероидов
Пример гормонорегуляторного
блока в схеме лечения больного раком предстательной железы,
не подвергавшегося орхиэктомии:
Зюзник европейский (трава)
Софора японская (плоды)
Хмель обыкновенный (соплодия)
Черника обыкновенная (побеги)
Цетрария исландская (слоевище)
Пример гормонорегуляторного
блока в схеме лечения больной раком молочной железы с сохраненной
менструацией:
Окопник лекарственный (корень)
Рута пахучая (трава)
Ярутка полевая (трава)
Золототысячник малый (трава)
Ламинария сахаристая (слоевище)
ГРБ в случаях гормонозависимых опухолей применяется
постоянно и нередко многомесячно со сменой состава растений каждые полтора-два
месяца.
В случае негормонозависимых опухолей
ГРБ назначается для профилактики осложнений со стороны половой сферы на фоне
проводимой химиотерапии больному с сохраненной репродукцией. В этой ситуации
травы, водящие в состав ГРБ, вводятся в схему лечения за две-три недели до
начала химиотерапии, и даются до ее окончания (или перерыва). После чего они
из схемы исключаются, и заменяются растениями, восстанавливающими функцию
половых желез. Чаще всего это «большие» адаптогены – элеутерокк, аралия, родиола
и т.д.
Выбор лекарственной формы, в которой
применяется то или иное антигонадотропное растение, зависит оттого, какая
часть растения используется, применяется оно одно или в сочетании с другими
травами, а также от индивидуальных особенностей конкретного больного. Наиболее
часто применяется отвар. В случаях, когда курс антигонадотропных растений
непродолжительный, мы применяем спиртовую настойку, добавляемую к отвару базисного
сбора сразу после его приготовления.
Заключение.
Итак,
на примере использования антигонадотропных растений в практике лечения онкологических
больных мы продемонстрировали оптимальный на наш взгляд подход к методике
выбора фитотерапевтической схемы. Современная фитотерапия онкологических больных
представляется нам стройной системой фармакологических знаний, проистекающих
от эмпирического народного опыта, проверенного многочисленными доклиническими
исследованиями с обязательным преломлением через критическую призму практической
клинической работы.
Приложение 1. Гипоталамо-гипофизарно-гонадальная
ось гормональной регуляции.
Приложение 2. Классификация растений по влиянию на гормональную
сферу
(Алефиров А.Н., 2006)
Список литературы.
1. Алефиров А.Н. Особенности
траволечения гормонозависимых опухолей. Материалы Международного съезда фитотерапевтов.
– Москва, 2006. – с. 14,
2. Алефиров А.Н. Опыт лечения травами рака молочной железы
у женщин в постменопаузе. Материалы симпозиума «Фитотерапия в онкологии».
– СПб, 2007,
3. Амасиаци Амирдовлат. Ненужное для неучей. – М.: Наука,
1990.
4. Бохман Я.В. Лекции по онкогинекологии. – М.: ООО «Медицинское
информационное агенство», 2007. – 304 с.
5. Гарин А.М. Эндокринная терапия и гормонозависимые опухоли.
– М. – Тверь: ООО «Издательство «Триада»», 2005. – 240 с.
6. Манухин И.Б., Тумилович Л.Г., Геворкян М.А. Клинические
лекции по гинекологической эндокринологии, – М.: ООО «Медицинское информационное
агенство», 2001.
7. Abd-Elazem IS, Chen HS, Bates RB, Huang RC. Isolation
of two highly potent and non-toxic inhibitors of human immunodeficiency virus
type 1 (HIV-1) integrase from Salvia miltiorrhiza. Antiviral Res. 2002 Jul;55(1):91-106.
8. Auf'mkolk M, Amir SM, Kubota K, Ingbar SH. The active
principles of plant extracts with antithyrotropic activity: oxidation products
of derivatives of 3,4-dihydroxycinnamic acid. Endocrinology. 1985 May;116(5):1677-86.
9. Auf'mkolk M, Ingbar JC, Amir SM, Winterhoff H, Sourgens
H, Hesch RD, Ingbar SH. Inhibition by certain plant extracts of the binding
and adenylate cyclase stimulatory effect of bovine thyrotropin in human thyroid
membranes. Endocrinology. 1984 Aug;115(2):527-34.
10. Chatterton RT. Inhibition of progestational activity
for fertility regulation. Res Front Fertil Regul. 1981 Feb;1(3):1-14.
11. Chen CP, Yokozawa T, Chung HY. Inhibitory effect of
caffeic acid analogues isolated from Salviae Miltiorrhizae Radix against 1,1-diphenyl-2-picrylhydrazyl
radical. Exp Toxicol Pathol. 1999 Jan;51(1):59-63.
12. Farnsworth NR, Bingel AS, Cordell GA, Crane FA, Fong
HH. Potential value of plants as sources of new antifertility agents I. J
Pharm Sci. 1975 Apr;64(4):535-98.
13. Findley WE, Hollstein U, Besch PK. Effect of purified
lithospermic acid and its oxidation product on luteinizing hormone release
in vitro. Biol Reprod. 1985 Sep;33(2):309-15.
14. Fung KP, Zeng LH, Wu J, Wong HN, Lee CM, Hon PM, Chang
HM, Wu TW Demonstration of the myocardial salvage effect of lithospermic acid
B isolated from the aqueous extract of Salvia miltiorrhiza. Life Sci. 1993;52(22):PL239-44
15. Hase K, Kasimu R, Basnet P, Kadota S, Namba T. Preventive
effect of lithospermate B from Salvia miltiorhiza on experimental hepatitis
induced by carbon tetrachloride or D-galactosamine/lipopolysaccharide. Planta
Med. 1997 Feb;63(1):22-6.
16. Kemper F., Loeser A. Blockade of pituitary hormones
and regulation of endocrine functions by means of Lithospermum officinale.
Acta Endocrinol (Copenh). 1960 Feb;33:251-4.
17. Li X, Yu C, Cai Y, Liu G, Jia J, Wang Y. Simultaneous
determination of six phenolic constituents of danshen in human serum using
liquid chromatography/tandem mass spectrometry. J Chromatogr B Analyt Technol
Biomed Life Sci. 2005 Jun 5;820(1):41-7. Epub 2005 Apr 19
18. Rompel A, Fischer H, Meiwes D, Buldt-Karentzopoulos
K, Magrini A, Eicken C, Gerdemann C, Krebs B. Substrate specificity of catechol
oxidase from Lycopus europaeus and characterization of the bioproducts of
enzymic caffeic acid oxidation. FEBS Lett. 1999 Feb 19;445(1):103-10.
19. Rompel A, Fischer H, Meiwes D, Buldt-Karentzopoulos
K, Dillinger R, Tuczek F, Witzel H, Krebs B. Purification and spectroscopic
studies on catechol oxidases from Lycopus europaeus and Populus nigra: evidence
for a dinuclear copper center of type 3 and spectroscopic similarities to
tyrosinase and hemocyanin. J Biol Inorg Chem. 1999 Feb;4(1):56-63.
20. Shigematsu T, Tajima S, Nishikawa T, Murad S, Pinnell
SR, Nishioka I Inhibition of collagen hydroxylation by lithospermic acid magnesium
salt, a novel compound isolated from Salviae miltiorrhizae Radix. Biochim
Biophys Acta. 1994 May 25;1200(1):79-83
21. Wagner, H., Horhammer, L. Frank V. Lithospermic acid,
the antihormonally active principle of Lycopus europaeus L. and Symphytum
officinale. 3. Ingredients of medicinal plants with hormonal and antihormonal-like
effect. Arzneimittelforschung. 1970 May; 20(5):705-13.


